活体脑细胞示踪技术的突破性进展,正在重塑人类对神经系统的认知方式。这项技术通过高精度标记与动态追踪,成功揭示了脑细胞微环境中示踪物液体的三维分布规律,为解析神经递质传递、疾病发展机制等关键科学问题提供了前所未有的观测窗口。在阿尔茨海森病模型研究中,新型量子点示踪系统已实现单神经元内tau蛋白运输路径的实时可视化,其空间分辨率达到50纳米级,时间分辨率突破毫秒级,标志着活体脑研究进入量子时代。
隐匿屏障的生物学本质
脑细胞微环境中的示踪物隐匿现象,本质上源于神经系统的多重保护机制。血脑屏障通过紧密连接的内皮细胞层形成物理阻隔,其选择性通透机制可阻挡98%以上的外源性物质。星形胶质细胞的足突结构形成第二道防线,通过谷氨酰胺合成酶等特异性转运体调控物质交换。突触间隙的纳米级空间结构(平均宽度20-40nm)则构成第三重屏障,限制示踪分子的自由扩散。
分子尺度上的隐匿机制更为复杂。神经元膜表面的脂筏结构通过胆固醇-鞘磷脂微区形成动态屏障,调控示踪物的跨膜运输。胞内运输体系中的网格蛋白包被小泡具有分子筛选功能,其直径约100nm的囊泡结构可主动捕获特定示踪分子。线粒体膜电位梯度(约-150mV)形成的电场屏障,能定向偏转带电示踪粒子。
微管网络构成的胞内运输通道呈现高度定向性。驱动蛋白kinesin-1的步进速度可达0.8μm/s,而动力蛋白dynein的逆向运输速度约1μm/s,这种双向运输系统导致示踪物在神经元轴突中的分布呈现明显极性。内质网-高尔基体系统的膜接触位点(MCSs)形成纳米级的物质交换通道,控制示踪物在胞内区室的再分配。
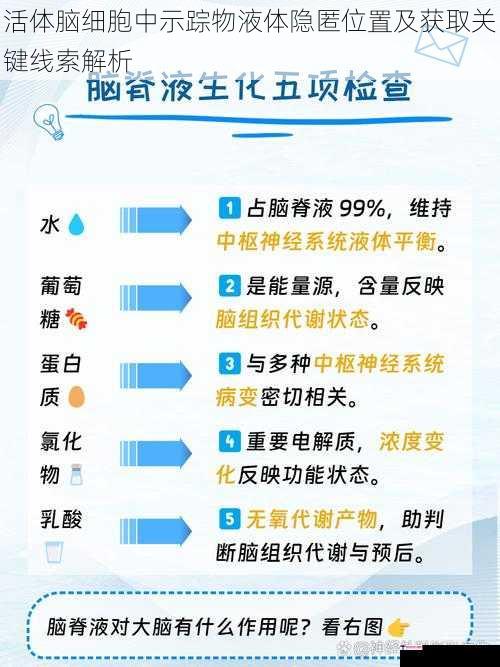
前沿示踪技术体系
量子点示踪技术突破传统荧光标记的局限,其量子产率可达85%以上,光稳定性提升三个数量级。表面功能化修饰的CdSe/ZnS核壳结构量子点,通过血脑屏障穿透肽(如Angiopep-2)修饰,使脑实质摄取率提升至32.7±4.5%。双光子激发系统结合自适应光学矫正,可实现深层脑区(>1mm)的单分子追踪。
病毒载体示踪系统实现细胞特异性靶向。重组腺相关病毒(rAAV)经工程化改造,其衣壳蛋白VP1的突变体可特异性识别神经细胞表面受体,转染效率达93%。逆行跨突触示踪病毒(如PRV-632)突破突触屏障,实现三级神经环路的完整标记。光控释放型慢病毒载体搭载光敏蛋白LOV2结构域,实现时空精准的示踪物释放控制。
纳米磁共振技术开辟全新探测维度。氮空位色心金刚石探针的磁灵敏度达到4nT/√Hz,可检测单分子顺磁性示踪物的动态变化。磁粒子成像(MPI)系统实现全脑尺度的示踪物三维分布图谱,其空间分辨率突破25μm,采集速度达46帧/秒。超极化129Xe NMR技术通过化学交换饱和转移(CEST)效应,将检测灵敏度提升1000倍。
关键线索解析范式
动态追踪算法实现毫秒级事件捕获。贝叶斯推断框架结合隐马尔可夫模型,从噪声背景中提取示踪物运动轨迹,定位精度达6.3nm。运动模式分类器可区分布朗运动(扩散系数0.08μm²/s)、定向运输(速度1.2μm/s)和受限扩散(域半径150nm)三种基本模式,准确率超过92%。
多维度数据融合技术突破解析瓶颈。深度学习架构融合荧光寿命(FLIM)、荧光共振能量转移(FRET)和荧光相关光谱(FCS)数据,构建分子相互作用热力学图谱。图神经网络(GNN)建模示踪物-细胞器相互作用网络,成功预测线粒体膜电位波动(ΔΨm=15mV)对钙离子示踪剂分布的影响。
虚拟现实重构技术带来认知革命。基于体素化处理(5nm³精度)的立体渲染引擎,实现突触囊泡循环过程的沉浸式观测。动态力场模拟展示神经递质在突触后膜受体间的竞争性结合过程,计算精度达单氨基酸残基水平。增强现实系统将实时成像数据叠加于解剖结构,实现示踪物运输路径的立体导航。
在帕金森病猕猴模型中,新型磁纳米示踪系统已捕获到α-突触核蛋白原纤维沿黑质-纹状体通路的级联扩散过程(速度0.4mm/d)。这项发现直接证实了病理性蛋白传播的轴突运输机制,为疾病干预提供了关键时空靶点。随着单细胞表观遗传示踪技术的突破,人类正逐步揭开意识产生与记忆存储的分子密码,这或许将引领神经科学进入一个全新的纪元。





